高中化学 关于键能共价键 H-H Cl-Cl H-Cl键能(KJ/mol) Q1 Q2 Q3正确的是 A Q1+Q2>Q3 B Q1+Q2>2Q3 C Q1+Q2<Q3 D Q1
来源:学生作业帮助网 编辑:作业帮 时间:2024/04/20 23:23:40
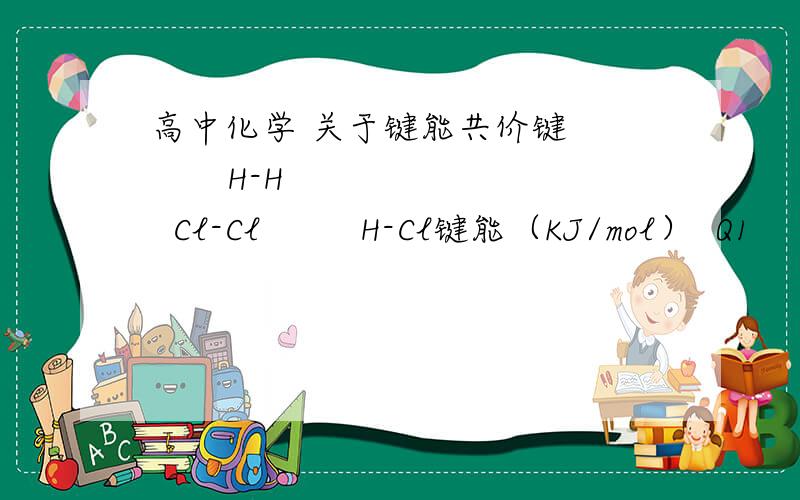
高中化学 关于键能共价键 H-H Cl-Cl H-Cl键能(KJ/mol) Q1 Q2 Q3正确的是 A Q1+Q2>Q3 B Q1+Q2>2Q3 C Q1+Q2<Q3 D Q1
高中化学 关于键能
共价键 H-H Cl-Cl H-Cl
键能(KJ/mol) Q1 Q2 Q3
正确的是 A Q1+Q2>Q3 B Q1+Q2>2Q3
C Q1+Q2<Q3 D Q1+Q2<2Q3
能不能给个理由啊?

高中化学 关于键能共价键 H-H Cl-Cl H-Cl键能(KJ/mol) Q1 Q2 Q3正确的是 A Q1+Q2>Q3 B Q1+Q2>2Q3 C Q1+Q2<Q3 D Q1
氢气+氯气=氯化氢.反应成立且是放热反应,反应热=生成物健能-反应物健能,故A正确.高三的应该会吧?
选D 什么理由
A支正确。H2+Cl2=2HCl,△H<0。放热反应,反应物键能之和大于生成物键能之和才会放出热量,故Q1+Q2>Q3。
首先我们知道氢气和Cl2的反应是放热的反应。所以H2和Cl2的总能量要大于2个HCl的能量。所以,
Q1+Q2<2Q3 能量的计算是1 反应物的总能量—生成物的总能量 或是 生成物的键能—反应物的键能。 选 D
A C不能确定
B是错的