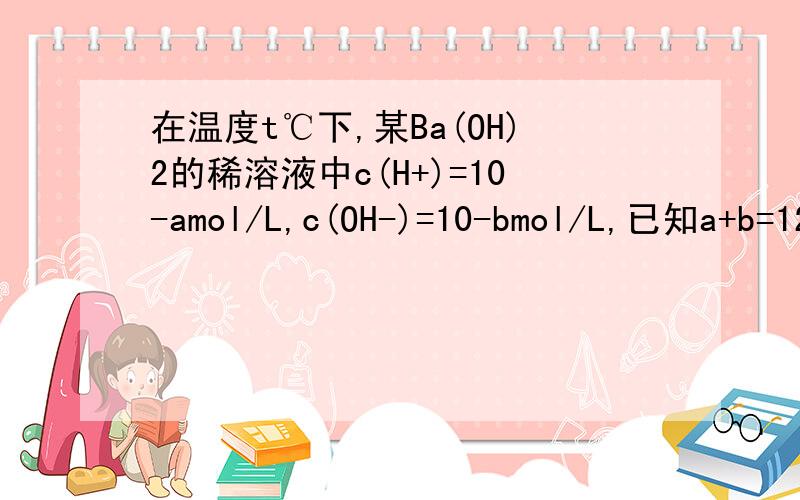
在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2
来源:学生作业帮助网 编辑:作业帮 时间:2024/04/27 16:06:44
在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2
在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大量,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为_________,以及其中Na2SO4的物质的量浓度为_________.
在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2
pH=4,c(Na2SO4)=10-4mol/L
由水的离子积Kw=c(H+)*c(OH-)=10-a*10-b=10-(a+b)
因为已知a+b=12,所以该温度下Kw=10-12,则中性时的pH=6,
由图中序号1知:Ba(OH)2的pH=8,c(H+)=10-8mol/L,c(OH-)=Kw/c(H+)=10-4mol/L
3L该Ba(OH)2稀溶液含n(OH-)=3*10-4mol,n(Ba2+)=1.5*10-4mol
设原混合溶液含xmolH2SO4,ymolNa2SO4
沉淀正好达最大量(Ba2+与SO42-恰好反应):x+y=1.5*10-4 ①
所得溶液取出4mL并加水稀释至20mL,pH为7说明:
所得溶液是碱性溶液,稀释后c(H+)=10-7mol/L,c(OH-)=Kw/c(H+)=10-5mol/L
稀释前c(OH-)=5*10-5mol/L
所得溶液的总体积=1L+3L=4L,n(OH-)=4*5*10-5mol/L=2*10-4mol
又因为原3LBa(OH)2稀溶液含n(OH-)=3*10-4mol
所以与xmolH2SO4中和的n(OH-)=3*10-4mol-2*10-4mol=10-4mol
则:2x=10-4 ②
联立方程组解得:x=0.5*10-4mol,y=10-4mol
原硫酸与硫酸钠溶液中:
c(H+)=2*0.5*10-4mol/1L=10-4mol/L,pH=4
c(Na2SO4)=10-4mol/1L=10-4mol/L
话说我看不到图。。。。。。